患者女性,84岁,主因「间断咳嗽、咳痰8年,加重伴发热、呼吸困难3天」于2018年11月5日入我院呼吸科普通疗区,11月6日因呼吸困难进一步加重转入RICU。
患者8年前无明显诱因出现晨起咳嗽、咳痰,咳白色粘痰,曾于当地医院诊断为「慢性支气管炎」,未系统治疗,无呼吸困难,入院前3天无明显诱因出现咳嗽加重,咳黄黏痰,量少,不易咳出,伴有发热,最高体温38.7℃,口服退热药物体温可降至正常。伴有呼吸困难,表现为反复发作性,剧烈咳嗽及活动后出现,于附近诊所给予抗感染、对症治疗(具体治疗方案不详),无明显好转,呼吸困难较前加重,为求进一步治疗来我院,急诊行胸部CT(见图1)检查提示右肺上叶、中叶支气管改变,双肺散在炎症改变,收入我科普通疗区。既往:发现高血压病史5年,血压最高180/90mmHg,间断口服拜新同,血压多控制于140/80mmHg;否认糖尿病、冠心病病史;否认吸烟、饮酒史。
入院查体
脉搏85次/分,血压140/90mmHg,指尖血氧89%,呼吸频率25次/分,双肺呼吸音粗,可闻及散在湿啰音,心脏、腹部检查未见异常,双下肢无水肿。
入院辅助检查
血常规:白细胞9.27×10^9/L,中性粒细胞百分比80%;CRP 106mg/L;尿常规:蛋白2+;心肌损伤标志物正常;D二聚体346ug/L,FDP正常;心电图大致正常;心脏彩超:左室舒张功能减低,主动脉瓣及二尖瓣瓣环钙化,三尖瓣轻度返流,EF60%。血气分析:PH 7.40,pO2 53mmHg,pCO243mmHg,HCO3- 23.5mmol/l,SO2 87%。
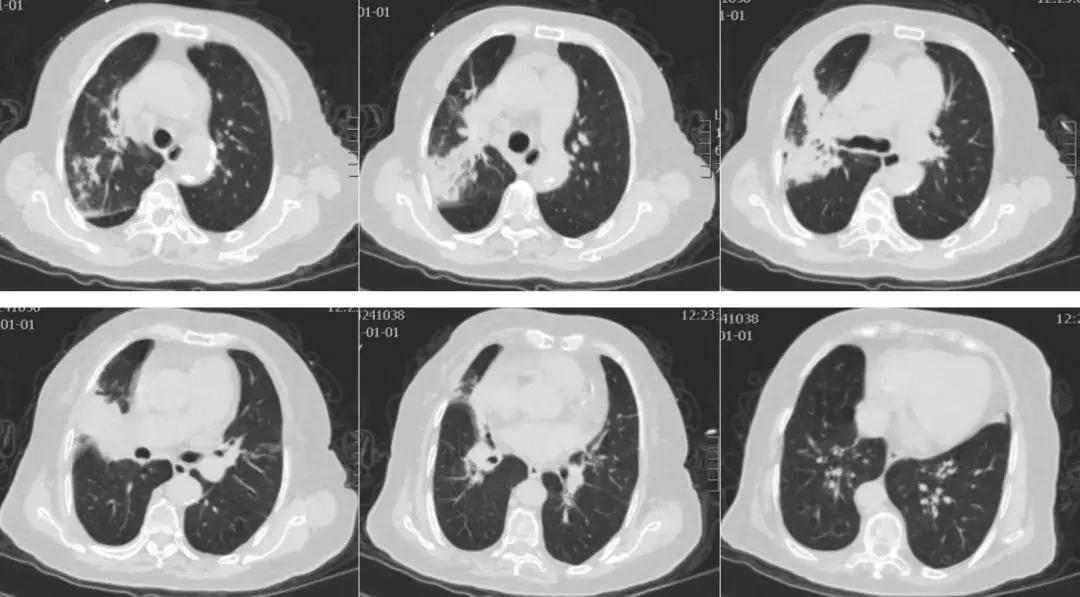
【图1】入院前急诊胸部CT:右肺上叶、中叶支气管改变,双肺散在炎症改变
入院诊断:慢性支气管炎急性发作、双肺肺炎、I型呼吸衰竭。
患者入院后给予莫西沙星,联合抗病毒、解痉平喘对症治疗。患者呼吸困难无明显缓解,11月6日轻度活动后出现呼吸困难明显加重,伴有口唇紫绀。查体:心率150次/分左右,血压200/100mmHg,指尖血氧70%左右,双肺满布哮鸣音,给予甲强龙40mg静推,异舒吉持续泵入降压及强心、利尿治疗,呼吸困难无明显缓解,逐渐出现意识淡漠。血气分析:PH7.25,PCO2 49mmHg,PO2 36 mmHg,HCO3- 21.5mmol/l,Lac3.0mmol/l,SO2 58%。
遂送至RICU行无创呼吸机辅助通气治疗,S/T模式:IPAP 15mmHg,EPAP 5mmHg,FiO2 50%,上机后患者呼吸困难逐渐缓解,指尖血氧升至98%,上机1小时后,心率110次/分左右,血压130/80mmHg,双肺可闻及少许干啰音,患者一般状态明显好转,急检心肌损伤标志物:肌钙蛋白I 0.088ng/ml,肌红蛋白109.2ng/ml,BNP 1110pg/ml,心内科会诊考虑低氧导致心肌损伤可能性大,故暂给予普米克令舒联合硫酸特步他林雾化吸入。因患者呼吸道病原核酸提示支原体感染,继续给与莫西沙星抗感染治疗。
患者入RICU第2天,无发热,呼吸困难明显好转,咳嗽减轻,停止呼吸机辅助通气。查体:心率85次/分,血压135/80mmHg,呼吸频率18~20次/分,指尖血氧96%(鼻导管低流量吸氧),双肺可闻及少许散在湿啰音。但患者于入监护室第3天再次出现呼吸困难,查体:心率130次/分,血压150/90mmHg,指尖血氧93%(鼻导管低流量吸氧),双肺满布哮鸣音,给予无创呼吸机辅助通气,雾化吸入治疗后,呼吸困难缓解,半小时后查体双肺未闻及干啰音,复查心肌损伤标志物大致正常,BNP 716pg/ml,此后患者间断反复出现呼吸困难加重,均于撤机后出现,再次给与无创呼吸机辅助通气后可缓解,撤机时间逐渐缩短,于入监护室1周后,无法撤离呼吸机辅助通气。但治疗期间无发热,咳嗽明显减轻,无咳痰,血常规白细胞、中性粒细胞、PCT均降至正常。
患者因何呼吸困难反复加重,无法撤离呼吸机?
分析病因如下:
1、心源性呼吸衰竭
患者为老年女性,既往有高血压病史,反复出现呼吸困难加重,活动耐力差,给予无创呼吸机辅助通气后呼吸困难可好转,不能除外心源性呼吸困难,但患者入院后心脏彩超仅提示舒张功能减低,射血分数正常,发病时及发病间期心肌损伤标志物及BNP均改变不明显,动态心电提示偶有房性期前收缩,不支持心衰诊断,且患者入监护室后严格液体管理,每日出入量基本平衡,无四肢及低垂部位水肿,均不支持心衰加重导致撤机困难。
2、与肺部原发病灶相关
患者肺部CT提示右肺上叶及中叶支气管改变,需警惕特殊疾病导致呼吸困难反复发作,如结核、真菌感染及肿瘤,但患者经抗感染治疗后未再发热,感染症状明显好转,入院后痰痰X-Pert及血T细胞斑点检查未提示结核感染,外送血GM试验未见异常,血IgE正常,肿瘤标志物正常,反复查痰脱落细胞未发现肿瘤细胞,因年龄高,病情加重,家属不同意气管镜检查,暂不能明确右肺改变原因,追问病史,家属诉患者于1年余前行肺部CT检查已经发现右肺改变,但未能提供之前肺部CT,无法与前片行对照分析。
3、哮喘
患者近期反复出现呼吸困难,既往无哮喘病史,无哮喘家族史,对激素雾化吸入反应不敏感,考虑哮喘导致呼吸困难可能性小,因病情重,未能完善静态肺功能及呼出气NO检查。
患者治疗陷入僵局,为明确呼吸困难原因,于入科第14天,行床旁心肺功能试验,同时复查肺部CT。结果提示运动心功能明显异常(见图2);肺CT(见图3)见右肺上叶、中叶改变较前无明显变化,炎症吸收好转,双侧胸腔积液。复查心脏彩超仍提示舒张功能减低,射血分数正常。
根据以上结果,考虑可能是保留射血分数的心功能不全(HFpEF),给予加强利尿治疗2天后,患者可停止呼吸机辅助通气,鼻导管低流量吸氧,指尖血氧95%,继续利尿治疗3天,患者可轻度床旁活动,未出现呼吸困难,好转出院。
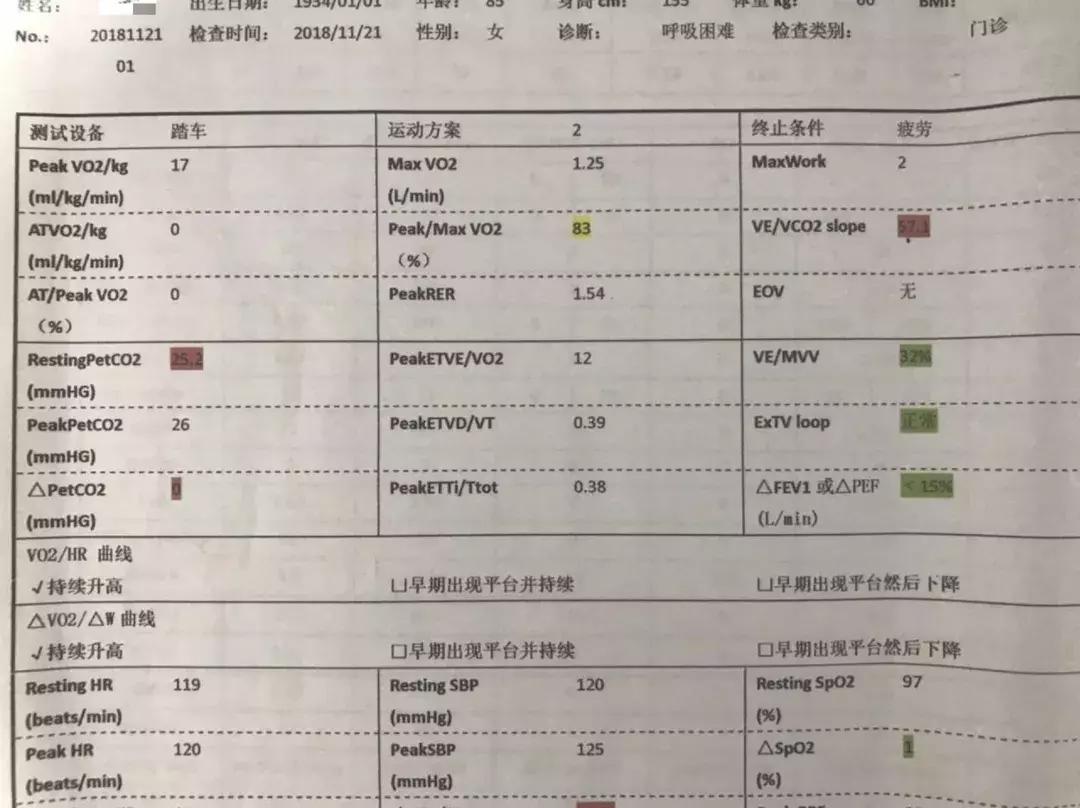
【图2】心肺运动试验:VE / VCO2 slope明显升高,RestingPETCO2明显下降,运动及静息PETCO2差值减小
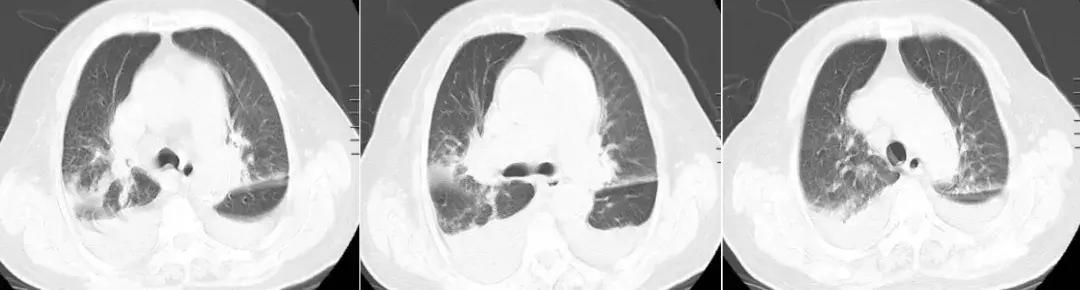
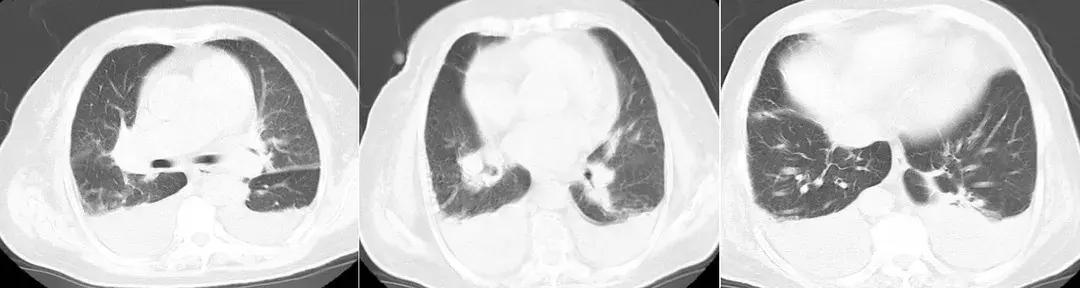
【图3】复查胸部CT:右肺上叶、中叶支气管改变,炎症吸收好转,双侧胸腔积液。
讨论:这个「古老」的工具或许应重归呼吸科医生的视野
心肺运动负荷试验出现于19世纪五六十年代,最早是用在评估运动员的运动能力[1,2,3]。在医学领域的应用则起始于呼吸科,为了评估运动性呼吸困难的患者。1984年,呼吸病专家Wasserman K.和Hansen JE共同研究并发表了运动负荷试验的临床预计值 [4]。并指出所有的运动均需要心脏功能和肺功能的协调,以及外周循环和肺循环的协调作用来完成生存和工作所需要的气体交换作用。之后,心脏科医生发现,配合平板运动进行心肺运动试验可以更好的评估心脏病人的血流动力学状态,而使得这项检查迅速在心脏病领域推广发展起来。目前,心肺运动试验(CPX)主要应用于对心脏疾病的分级、心脏事件风险的评估,心肺康复运动方案的制定以及鉴别呼吸困难为心源性、肺源性、心肺混合性等多个方面。
心肺运动试验(cardiopulmonary exercise testing,CPX)是评估整体运动功能,尤其是呼吸、循环系统功能以及二者相互协调作用的一项无创性的、可靠的、客观的辅助检查手段,特别强调心肺联合功能的测定。通过采集和分析不同运动负荷状态下多种反映人体心肺储备功能及运动耐力的客观定量指标,可以综合评定受试者整体功能状态 [5]。
本病例中通过床旁心肺运动试验,成功诊断一例反复呼吸困难加重、撤机困难并且心脏相关检查未提示明确诊断的老年患者为心源性呼吸困难,通过改善心脏功能治疗,最终成功撤机,提示床旁心肺运动试验对于心肺功能异常的重症患者的治疗具有重要指导作用。下面让我们结合这个病例来复习一下心肺运动试验的核心内容。
目前,心肺运动核心是四个CPX变量,它们可以独立的和共同的代表通气效率:
1)每分钟通气量/二氧化碳产量(the minute ventilation/carbon dioxide production,VE / VCO2)斜率;
2)呼末二氧化碳(the partial pressure of end- tidal carbon dioxide,PETCO2)的分压;
3)运动振荡通气(exercise oscillatory ventilation,EOV);
4)氧气吸收效率斜率(the oxygen uptake efficiency slope,OUES)[6]。
1、VE / VCO2斜率检测
AHA和EACPR最近发表的关于CPX的联合声明建议应对所有接受心肺运动试验的心衰患者行VE / VCO2斜率检测,而不论其病因如何 [7]。EACPR / AHA指南推荐使用运动数据评估VE / VCO2斜率的4级方法(VC法),具体为:其值小于30 [VC-I级]代表正常反应;VE / VCO2斜率分别为30.0~35.9(VC-II级),36.0~44.9(VC-III级)和≥45.0(VC-IV级)表明异常反应逐渐增加,反映的不良事件发生率升高 [8]。
导致VE / VCO2斜率异常升高的病理生理机制是多因素的,包括异常的呼吸力学和间质性肺改变,化学感受器敏感性升高,体力活动时代谢性酸中毒加速,肺血流动力学异常和心脏功能受损 [9]。其中一个重要的病理生理因素是继发性肺动脉高压的发展 [10]。总结来说,这些机制均可导致通气血流比失调,提示如果达到一定的二氧化碳产出量,需要的肺通气量更高。VE / VCO2斜率能够准确检测心功能不全患者发生继发性肺动脉高压所引起的通气 - 灌注失调的加重,随着继发性肺动脉高压在心功能不全中的进展,右心室开始发生结构及功能改变,因此升高的VE / VCO2斜率也与肺动脉压升高对右心室的压力增加有关 [11-12]。左心功能不全出现继发性肺动脉高压和右心室功能受损是患者预后差的明显指征 [13-15]。
EACPR / AHA最近公布的CPX声明支持使用VE / VCO2斜率作为心衰患者的主要预后标志物,支持使用前面描述的VC系统评分 [7]。VE / VCO2斜率≥45.0的心力衰竭患者(即VC-IV)具有特别高的不良事件风险。已经证实VE / VCO2斜率升高在不同程度上可以通过用药、生活方式和手术干预进行逆转 [7,16-21]。但本病例中,患者为高龄患者,病情重,仅可能药物干预,因患者2次心脏彩超提示射血分数正常,舒张功能减低,虽心脏结构正常,提示可能存在肺循环异常甚至右心功能异常,经给予加强利尿治疗后,成功撤机,好转出院,患者后期可考虑专业医生指导下心脏康复治疗。
2、PETCO2
与心衰患者的病理生理学相关,PETCO2与VE / VCO2斜率具有高度的相似性。较低的PETCO2与严重的通气 - 灌注失调、肺动脉压力升高和右心室功能不全相关。静息和运动状态下的PETCO2值对于心衰患者的评估都很重要。静息状态下PETCO2的正常值在36~42mmHg之间;通常,在极量运动期间,增加3~8mmHg [22]。最近的EACRP / AHA关于CPX的声明认为PETCO2是评估心衰患者的关键变量 [7],静息PETCO2<33.0 mmHg和/或极量运动期间增加<3 mmHg被认为是异常反应。该患者静息PETCO2明显减低,且运动中△PETCO2无明显变化,同样考虑存在严重通气-血流失调,可能为心功能异常导致肺循环异常所致。
3、EOV及OUES
EOV被定义为振荡VE模式,要求其静息时间持续≥60%的运动试验,其幅度≥15%的平均静息值 [23]。关于EOV的病理生理学机制仍在探索中,包括心输出量和循环时间受损,化学感受器反应异常,中枢神经系统通气控制受损,右心室功能障碍,肺血流动力学异常,以及与肺毛细血管到外周和中央化学感受器的动脉CO2水平相关的信息传递延迟,心脏功能下降的结果都被认为是与EOV协同作用的机制 [9,23-27]。此外,运动训练可以有益/改善EOV。
氧气吸收效率斜率(oxygen uptake efficiency slope,OUES)最初是由Baba等人 [28] 在1996年提出的,并且自那时以来已经在心衰患者中进行了广泛的评估。OUES提示氧消耗和分钟通气量的对数变换之间的关系。除了反映心肺循环相互作用之外,呼吸系统(即,吸氧能力的效率)和骨骼肌(即,外周利用氧气的能力)也在OUES中起作用,因此需要进一步的工作来更好地定义OUES与心衰的病理生理学之间的关系。但有一系列文献证明OUES对心衰患者的预后效用 [29-31]。
以上2项变量均需要一定运动时间和强度,因该患者行该项检查时活动耐力极差,未能测出有意义结果,进一步评估有赖于病情好转后复查CPX。
综上所述
床旁心肺运动试验适用于危重症患者心功能评估及鉴别呼吸困难主要原因,指导针对性治疗,配合床旁心肺康复治疗,有利于改善慢性病反复加重患者的预后及生活质量。这项检查在国外开展已有数十年的历史,广泛应用于临床医学、运动医学、康复医学等领域。目前在国内主要应用于心脏康复领域,呼吸领域的医务工作者普遍缺乏对心肺运动试验的深刻认识和掌握。希望此文能加深呼吸领域医生对此项检查的印象,逐渐使这项最早由呼吸科医生启用的临床检查手段重归呼吸科医生的视野,为呼吸系统疾病诊治提供有利的工具。
参考文献
[1] Astrand PO. Experimental studies of physical working capacities in relation to sex and age.
Copenhagen: Munksgaard 1952.
[2] Buskirk E, Taylor HL. Maximal oxygen in-take and its relation to body composition, with special reference to chronic physical activity and obesity. J Appl Physiol 1957;11:72-8.
[3] Shephard RJ, Allen C, Benade AJS, et al. The maximum oxygen intake. Bull WHO 1968; 38:757-64.
[4] Hanson JS, Tabakin BS, Levy AM. Comparative exercise-cardiorespiratory performance of normal men in the third, fourth, and fifth decades of life. Circulation 1968; 37:345-60.
[5] 夏蕊,孙兴国,黄燕.心肺运动试验中通气效率在心肺疾病中的应用[J].中国老年保健医学,2018,16( 4) : 70-72.
[6] Jonathan Myers PhD, Ross Arena PhD, PT, Lawarence P. CahalinPhD, PT, Valentina Labate MD, Marco Guazzi MD, PhD, Cardiopulmonary ExerciseTesting in Heart Failure, CurrProblCardiol, http://dx.doi.org/10.1016/j.cpcardiol.2015.01.009
[7] Forman DE; Kitzman DW; Lavie CJ; Myers J. EACPR/AHA Scientific Statement.Clinical Recommendations for Cardiopulmonary Exercise Testing Data Assessment inSpecific Patient Populations. Circulation. 2012; 126: 2261-2274
[8] Arena R, Myers J, Abella J et al. Development of a Ventilatory Classification System inPatients With Heart Failure. Circulation 2007;115:2410-7.
[9] Guazzi M. Abnormalities in cardiopulmonary exercise testing ventilatory parameters inheart failure: pathophysiology and clinical usefulness. Curr Heart Fail Rep 2014;11:80-7.
[10] Guazzi M, Cahalin LP, Arena R. Cardiopulmonary exercise testing as a diagnostic toolfor the detection of left-sided pulmonary hypertension in heart failure. J Card Fail 2013;19:461-7.
[11] Lewis GD, Shah RV, Pappagianopolas PP, Systrom DM, Semigran MJ. Determinants of ventilatory efficiency in heart failure: the role of right ventricular performance and pulmonary vascular tone. Circ Heart Fail 2008;1:227-33.
[12] Ukkonen H, Burwash IG, Dafoe W et al. Is ventilatory efficiency (VE/VCO2 slope) associated with right ventricular oxidative metabolism in patients with congestive heart failure? European Journal of Heart Failure 2008;10:1117-22.
[13] Damy T, Goode KM, Kallvikbacka-Bennett A et al. Determinants and prognostic value of pulmonary arterial pressure in patients with chronic heart failure. European Heart Journal 2010;31:2280-90.
[14] Ghio S, Gavazzi A, Campana C et al. Independent and additive prognostic value of right ventricular systolic function and pulmonary artery pressure in patients with chronic heart failure. Journal of the American College of Cardiology 2001;37:183-8.
[15] Kalogeropoulos AP, Vega JD, Smith AL, Georgiopoulou VV. Pulmonary Hypertension and Right Ventricular Function in Advanced Heart Failure. Congestive Heart Failure 2011;17:189-98.
[16] Guazzi M, Arena R. The impact of pharmacotherapy on the cardiopulmonary exercise test response in patients with heart failure: a mini review. CurrVascPharmacol2009;7:557-69.31
[17] Guazzi M, Myers J, Peberdy MA, Bensimhon D, Chase P, Arena R. Ventilatory efficiency and dyspnea on exertion improvements are related to reduced pulmonary pressure in heart failure patients receiving Sildenafil. Int J Cardiol2010;144:410-2.
[18] Guazzi M, Vicenzi M, Arena R, Guazzi MD. PDE5 Inhibition With Sildenafil Improves Left Ventricular Diastolic Function, Cardiac Geometry, and Clinical Status in Patients With Stable Systolic Heart Failure / Clinical Perspective. Circ Heart Fail 2011;4:8-17.
[19] Van Tassell BW, Arena RA, Toldo S et al. Enhanced interleukin-1 activity contributes to exercise intolerance in patients with systolic heart failure. PLoS One 2012;7:e33438.
[20] Myers J, Dziekan G, Goebbels U, Dubach P. Influence of high-intensity exercise training on the ventilatory response to exercise in patients with reduced ventricular function. Med Sci Sports Exerc1999;31:929-37.
[21] Kim CH, Cha YM, Shen WK, MacCarter DJ, Taylor BJ, Johnson BD. Effects of atrioventricular and interventricular delays on gas exchange during exercise in patients with heart failure. The Journal of Heart and Lung Transplantation 2014;33:397-403.
[22] Arena R, Sietsema KE. Cardiopulmonary exercise testing in the clinical evaluation of patients with heart and lung disease. Circulation 2011;123:668-80.
[23] Corra U, Giordano A, Bosimini E et al. Oscillatory ventilation during exercise in patients with chronic heart failure: clinical correlates and prognostic implications. Chest 2002;121:1572-80.
[24] Murphy RM, Shah RV, Malhotra R et al. Exercise Oscillatory Ventilation in Systolic Heart Failure: An Indicator of Impaired Hemodynamic Response to Exercise. Circulation 2011;124:1442-51.
[25] Olson LJ, Arruda-Olson AM, Somers VK, Scott CG, Johnson BD. Exercise oscillatory ventilation: Instability of breathing control associated with advanced heart failure. Chest 2008;133:474-81.
[26] Guazzi M, Arena R, Ascione A, Piepoli M, Guazzi MD. Exercise oscillatory breathing and increased ventilation to carbon dioxide production slope in heart failure: An unfavorable combination with high prognostic value. American Heart Journal 2007;153:859-67.
[27] Guazzi M, Myers J, Peberdy MA, Bensimhon D, Chase P, Arena R. Exercise oscillatory breathing in diastolic heart failure: prevalence and prognostic insights. European Heart Journal 2008;29:2751-9.
[28] Baba R, Nagashima M, Goto M et al. Oxygen intake efficiency slope: a new index of cardiorespiratory functional reserve derived from the relationship between oxygen consumption and minute ventilation during incremental exercise. Nagoya J Med Sci 1996;59:55-62.
[29] Myers J, Oliveira R, Dewey F, Arena R, Guazzi M, Chase P, Bensimhon D, Peberdy MA, Ashley E, West E, Cahalin LP, Forman DE. Validation of a cardiopulmonary exercise test score in heart failure. Circ Heart Fail 2013;6:211-8.
[30] Ehrman JK, Brawner CA, Weaver D, Jacobsen G, Keteyian SJ. Oxygen Uptake Efficiency Slope and Survival in Patients with Systolic Heart Failure. Journal of the American College of Cardiology 47[4], 155A. 2006.
[31] Davies LC, Wensel R, Georgiadou P et al. Enhanced prognostic value from cardiopulmonary exercise testing in chronic heart failure by non-linear analysis: oxygen uptake efficiency slope. Eur Heart J 2006;27:684-90.
作者介绍

版权声明:CosMeDna所有作品(图文、音视频)均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系删除!
本文链接://www.cosmedna.com/article/659956834.html