药品生产用一次性系统组件和容器密闭系统(以下简称包装系统),都会有引入可提取物和浸出物(extractable & leachable,E&L)的可能性。如果E&L暴露量超过其安全阈值,可能会影响药品的安全性和有效性,给人体健康带来风险[1],如导致蛋白产生聚体[2]、引发其他疾病[3]等。因此需要对E&L进行毒理学研究和相关评估,如遗传毒性、系统毒性和生殖发育毒性等,以明确风险和降低不确定性。
E&L的毒理学研究主要是基于相关文献报道的毒理试验数据,结合人暴露量进行评估。不同于其他原料药或制剂中杂质,E&L更具复杂性。首先,种类繁多,包括如挥发性物质、半挥发性或非挥发性物质、元素和其他特定物质(如多环芳烃类和亚硝胺类物质)等;其次,常有化学结构尚不完全清晰的未知物,特别是采用液相色谱质谱联用(LC-MS)技术时,没有类似于气相色谱质谱的标准谱库可用于定性检索。这些复杂性导致部分E&L缺乏毒理数据,对毒理学风险评估带来很大挑战[4]。
本文较为系统地介绍E&L的毒理评价策略,包括安全阈值确定、毒理数据的查询和评价。对于毒理数据不充分的化合物可通过一系列方法进行评估,例如细菌回复突变试验数据初步判定含有警示结构化合物的特性[5],如果细菌回复突变试验呈阳性,则需引入毒理学关注阈值(threshold toxicological concern,TTC);对于无诱变试验数据的化合物,可应用定量结构活性关系(quantitative structure-activity relationship,QSAR)软件预测来确定控制策略;对于结构未知物,可按照诱变性杂质进行控制。E&L的毒理评价策略对其安全性评估具有重要意义。
1 E&L安全性评估
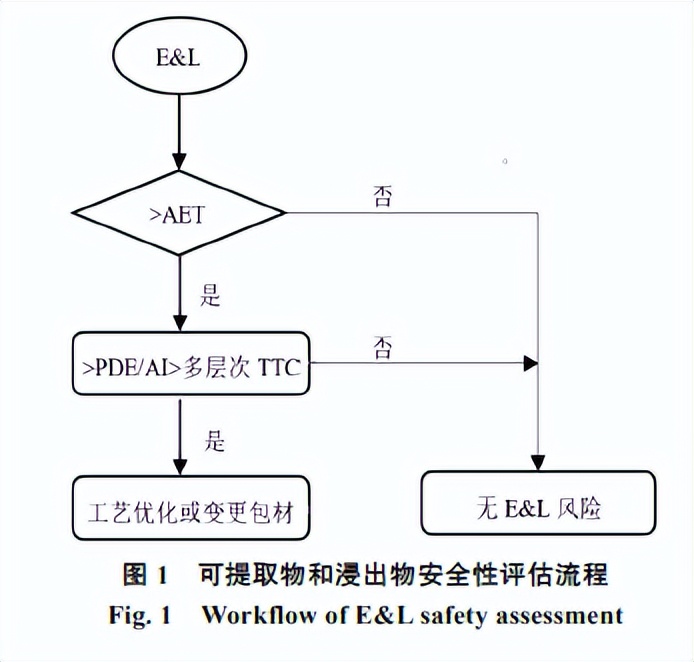
国内外的监管机构均明确要求药物上市申报中E&L研究的必要性[6-9],对分析得出的E&L进行安全性评估是其研究的重要内容。评估流程见图1。首先,结合临床给药剂量和TTC,安全性关注阈值(safety concern threshold,SCT)或界定阈值(qualification threshold,QT),计算得出分析评价阈值(analytical evaluation threshold,AET)[10];其次,对所测得E&L含量和AET进行比较,若超过AET,则需进一步结构分析和毒理学风险评价,可采用安全阈值,如人每日允许最大暴露量(permitted daily exposure,PDE)、可接受日摄入量(acceptable intake,AI)和多层次TTC;最后,如果E&L含量高于PDE、AI、多层次TTC,建议优化生产工艺参数(如稀释倍数、辅料成分、温度和效期等),或者更换包装材料或一次性组件。AET的取值一般源于TTC、SCT或者QT。
1.1 TTC
关于TTC的运用,在食品、化妆品和工业化学品等领域有许多文献报道[11]。考虑到药物带来的益处,TTC指的是E&L允许暴露水平。当TTC低于1.5 μg·d-1暴露水平时,无论是否获得化学特异性的毒性数据,在终生服用的情况下对人体健康都不会产生明显的危害[12],同时考虑到某些药品并非终生给药,国际人用药品注册技术协调会(ICH)M7根据给药时长[13],对TTC进行了调整。抗肿瘤药或者急救类药品,给药获益大于给药伤害,可以根据累计给药时长来放宽接受标准,如某单抗3周给药1次,最长给药时间为1年,那么它的累计给药时间是1~12个月,其TTC可以选用20 μg·d-1。
1.2 SCT
SCT是在TTC基础上,国际药用气雾剂联盟(International Pharmaceutical Aerosol Consortium,IPAC)引入的概念。美国产品质量研究学会(the Product Quality Research Institute,PQRI)推荐界定策略,吸入制剂和鼻腔制剂每人0.15 μg·d-1,注射制剂1.5 μg·d-1,当摄入量低于SCT控制水平,杂质的致癌毒性和非致癌毒性的担忧均可忽略不计[22]。
1.3 QT
非致癌的E&L,根据USP<1664>[9]推荐的方法,AET计算时可以采用QT值(5 μg·d-1)。
2 安全阈值PDE、AI、TTC的计算
当E&L的水平高于AET时,不能直接定义为高风险,需要引入PDE、AI或多层次TTC进行安全性评估。
2.1 PDE
PDE指某一物质被允许摄入而不产生毒性的日平均最大剂量,是由不产生反应量、体质量调整系数、种属之间差异系数、个体差异和短期接触急性毒性研究的可变系数等推算出。具体数值是由相关动物研究中的未观察到作用水平(no observed effect level,NOEL)、未观察到有害作用剂量(no observed adverse effect level,NOAEL)或最小可见损害作用水平(lowest observed adverse effect level,LOAEL)得出。一般情况下体质量取50 kg,用于治疗儿童或者婴幼儿疾病,体质量应该有所调整[14]。PDE使用ICH Q3C[15]和ICH Q3D[16]中公式推导,非肠道处理途径需要引入校正因子F1~F6,见表1。
PDE=NOEL/NOAEL/LOAEL×体质量/F1×F2×F3×F4×F5×F6
表 1 校正因子
Table 1 Modifying factors
校正因子 | 考虑因素 | 校正因子取值 |
F1 | 物种间差异 | F1=5(大鼠),12(小鼠),2(犬),2.5(家兔),3(猴) |
F2 | 人种差异 | F2=10(默认) |
F3 | 暴露的时间 | F3=1,研究时间至少为动物寿命1/2(啮齿动物或兔1年,猫、狗和猴7年),或涵盖整个器官形成期生殖研究 F3=2,6个月的啮齿动物或3.5年的非啮齿动物研究 F3=5,3个月的啮齿动物或2年的非啮齿动物研究 F3=10,持续时间更短的研究 |
F4 | 毒性严重性 | ● 重复染毒试验采用以下因子 F4=1,有非遗传毒性致癌性 F4=10,无非遗传毒性致癌性 ● 生殖发育试验采用以下因子 F4=1,与母体毒性有关的胎儿毒性 F4=5,无母体毒性的胎儿毒性 F4=5,有母体毒性的致畸反应 F4=10,无母体毒性的致畸反应 |
F5 | 未确定无反应水平时 可应用的可变因子 | F5=1,有NOAEL/NOEL数值 F5=10,有LOAEL/LOEL |
F6 | 口服换算非肠道给药 生物因子 | F6=100,口服生物利用度<1% F6=10,口服生物利用度≥1%且<50% F6=2,口服生物利用度≥50%且<90% F6=1,口服生物利用度≥90% |
在无口服生物利用度数据或职业吸入暴露限度的情况下,以口服PDE值除以校正因子100来计算吸入PDE[16]。关于生物利用率F6系数的调整,有部分研究学者建议需要综合毒效学和毒动学因子进行调整。
2.2 AI
致癌和致突变的物质,如黄曲霉毒素及其结构类似物、多环芳烃(PNAs/PAHs)、亚硝胺类(N-nitrosamines),可用AI值界定安全性阈值。通过给定的50%肿瘤发生率(TD50)线性外推法来计算化合物的可接受摄入量(AI=TD50×50 kg/50 000)[13]。
2.3 多层次TTC
若化合物基因突变结果为阴性(可通过Ames细菌回复突变结果初步判断),可采用以结构分类为基础的多层次TTC衍生法,即Cramer决策树分类。根据分子结构反映的毒性大小将化合物分成3类:Cramer结构类Ⅰ、Ⅱ和Ⅲ,对应得TTC值分别为每人1 800、540、90 μg·d-1[17-18],该阈值针对的是口服给药途径,评估非肠道给药途径下非基因毒性化合物的阈值还需考虑生物利用度。Cramer分类可以通过QSAR软件(如Toxtree或者OECD toolbox等)进行预测。
在不能获得Ames试验数据的情况下,ICH M7提出可以通过QSAR软件来预测是否具有诱变性,目的是预测细菌致突变试验结果。通常采用两种互补的QSAR方法,即专家知识规则和统计学规则。若两种方法均没有预测到警示结构,则足以得出该杂质没有致突变性的结论。QSAR模式采用的这些预测方法应服从经济合作与发展组织(Organization for Economic Co-operation and Development, OECD)制订的通用验证原则。目前可获得的QSAR预测软件有商业和非商业软件,见表2。
表 2 QSAR预测软件
Table 2 List of QSAR predictive software
专家知识规则 | 统计学规则 | 专家知识和统计学规则 |
Derek Nexus (Commercial) OECD Toolbox (Free) Toxtree (Free) | Sarah Nexus (Commercial) EPA T.E.S.T (Commercial) TOPKAT (Commercial) CAESAR (Free) VEGA (Free) | Lead scope (Commercial) Vlife (Commercial) |
3 E&L的毒理学数据评价
3.1 毒理学观测指标
完整的毒理学数据主要包括急性毒性、重复染毒、皮肤过敏、眼睛刺激、皮肤过敏、遗传毒性、致癌、生殖与发育毒性试验和其他专项研究(例如免疫毒性、神经毒性)等相关数据。毒理学数据可从公开数据库如欧洲食品安全局(European Food Safety Authority,EFSA),欧洲化学品管理局(European Chemicals Agency,ECHA),美国国家环境保护局(U.S. Environmental Protection Agency,USEPA),美国毒物与疾病登记署(Agency for Toxic Substances and Disease Registry,ATSDR),美国国家毒理部(National Toxicology Program,NTP),经济合作与发展组织(Organization for Economic Co-operation and Development,OECD),以及商用数据库如Toxplanet和毒理学参考文献中获得。
毒理学试验主要观测的指标有以下3个方面[19]:(1)活体评价,包括观测外表(体表通道和毛色),社会行为(躁动、冷静等),体质量,饲料消耗和食物利用率,眼科学检查,血压和心电图;(2)血液学和血液生化分析指标,包括血液学指标(血常规等),血生化指标(各项酶活等)和尿液的外观、比重和pH值等尿常规检测等;(3)尸检和组织病理学检查,包括器官质量和所有肉眼所见损害都应进行显微镜检测。
3.2 良好毒理试验选择
良好毒理试验选择应考虑动物物种、染毒途径、剂量选择和染毒周期[19]。
动物选择:毒性试验一般选择大鼠、小鼠和犬等。需要考虑试验动物的年龄以及雌雄比例,亚慢性毒性一般选择6~8周大鼠,慢性毒性应选择初离乳大鼠,生殖毒性应选择器官形成期阶段如大小鼠6~15 d,家兔6~18 d。
染毒途径:最常用的处理途径是口服灌胃、非肠道和经皮。不同处理途径的数据应用,参考ICH Q3D推荐的校正因子。
剂量选择:试验要得出明确的剂量反应关系和NOAEL,应该有低、中、高3个剂量组和1个阴性对照组。理想的高剂量组引起明显的毒性,中剂量相当于LOAEL,低剂量相当于NOAEL。
染毒周期:重复剂量长期染毒一般选择大于1个月,生殖发育染毒周期应该包括器官形成期和子代成长期。
3.3 关键毒性效应的选择
关键毒性效应容易造成动物毒副效应,且随着处理剂量提高越发显著[20],因此选择合理的关键毒性效应,得到NOAEL、NOEL、LOAEL至关重要[21]。毒性效应的选择应该基于重复染毒试验或者生殖发育毒性试验[15],而非短期毒性和局部处理毒性数据(如急性毒性,刺激毒性和过敏效应等),后者反映杂质毒性的大小,如半数致死量(LD50),但不可用于PDE计算。优先考虑选择人体的毒性数据,其次选择哺乳动物,如啮齿和非啮齿类动物毒性数据,最后考虑体外试验结果。关键毒性效应的选择,下文根据毒理数据是否充分进行讨论。
3.3.1 毒理数据充分
权威结构报道的安全性阈值可以直接引用,如ICH Q3C残留溶剂和ICH Q3D元素的安全性阈值。对于注射剂或吸入制剂,优先考虑接触途径是非肠道染毒的毒理学试验,其次是肠道染毒。病人为孕妇时,重点考虑在生殖发育方面的毒理学数据。
E&L属于外源性杂质[22],在有不同的数据报道时,优先选择NOEL或NOAEL的毒理数据,若无明确的NOEL或NOAEL,可选择LOAEL的毒理数据。如有多个独立重复染毒试验,首先考虑具有明确定义的毒理数据结果,其次选择相对保守数值,使PDE相对较小。如二苄基醚[23],1项为期90 d的亚慢性毒性试验得到的NOEL为3 mg·kg-1·d-1,试验没有观测到相关临床指标的变化;另1项为期91 d的亚慢性毒性试验,大鼠分别给予0、62、196、620 mg·kg-1·d-1二苄基醚,根据动物肝脏质量的变化确定了NOEL为196 mg·kg-1·d-1,最终确定NOEL为196 mg·kg-1·d-1,并以此来计算二苄基醚的PDE。
又如抗氧剂168[24],在1项重复染毒毒性试验,大鼠ig给予0、125、250、500、1 000 mg·kg-1·d-1抗氧剂168连续13周,确定了NOAEL为≥1 000 mg·kg-1·d-1。1项为期2年重复剂量毒性研究试验,大鼠每周通过喂饲法给与0、100 mg·kg-1·d-1抗氧剂168,确定该研究中的NOAEL为大于100 mg·kg-1·d-1。生殖发育毒性试验,雌性灰鼠兔(每组20只)从妊娠第6~18天开始经口插管喂饲0、200、600、1 200 mg·kg-1·d-1抗氧剂168,确定母体和发育毒性的NOAEL≥1 200 mg·kg-1·d-1。因此最终选择100 mg·kg-1·d-1为抗氧剂168的NOAEL。
系统毒性的毒理数据有时不足以支持生殖发育毒性的安全点。如沙利度胺[14],犬ig给予0、43、200、1 000 mg·kg-1·d-1沙利度胺,染毒周期53周,各染毒剂量均没有发现任何严重的系统毒性,确定该试验的NOAEL为1 000 mg·kg-1·d-1。在另外1项家兔发育毒性研究中,分别ig给予家兔沙利度胺0、10、50、100 mg·kg-1·d-1,发现不同染毒剂量均导致家兔胚胎毒副作用,该试验确定LOAEL为10 mg·kg-1·d-1,最终沙利度胺的PDE计算应选用生殖毒性试验得到的LOAEL。靶器官毒性物质(只针对某个器官或组织),在毒理学数据NOAEL选择上倾向于物质对这些靶器官毒性表现,如三氯甲烷的肝毒性、甲醇视神经毒性、苯容易导致再生障碍性贫血等。
高致癌性和致突变的物质被称为“关注队列”,如黄曲霉毒素、亚硝胺类以及烷基-氧化偶氮结构化合物等,其剂量与效应之间的关系是线性的,可接受摄入量采用线性外推法计算,选择最敏感物种和对诱导最敏感的肿瘤发生部位TD50计算,并遵守从严原则。如N-二甲基亚硝胺,大鼠TD50为0.095 9 mg·kg-1·d-1,小鼠TD50为0.189 mg·kg-1·d-1,最终选用大鼠TD50[25]。
不具有致突变性、且遗传毒性并非是致癌性作用方式的关键点,其剂量与效应之间的关系非线性的,可能需要浓度达到一定阈值才能形成肿瘤,这些物质根据线性外推计算该肿瘤形成的安全阈值是不合理的。如致癌物苯胺和盐酸苯胺[26],1项为期2年的大鼠致癌性研究数据,染毒剂量7.2、22、72 mg·kg-1·d-1,在大剂量雄性动物中观察到肿瘤,并在22 mg·kg-1·d-1组发现1个脾脏间质肉瘤。基于这些数据,确定7.2 mg·kg-1·d-1作为肿瘤的NOEL;另1项103周试验,大鼠食物中分别给予3×10-3、6×10-3盐酸苯胺,确定TD50为160 mg·kg-1·d-1[27]。因此,应选择NOEL 7.2 mg·kg-1·d-1来计算苯胺和盐酸苯胺的安全阈值。
3.3.2 毒理数据缺乏 若E&L毒理学试验数据缺乏,其毒理学评价从以下方面考虑。
通过同族系化合物替代。如3-甲基戊烷,未发现有关急性或重复剂量毒性或发育毒性信息。烷烃是中枢神经系统抑制剂和一般刺激物,有相关研究报道烷烃的神经毒性排序为:正己烷>甲基环戊烷>3-甲基戊烷>2-甲基戊烷[28],因此正己烷毒理数据可适用于3-甲基戊烷。又如聚己内酰胺,缺乏有效毒理学数据,单体的生物利用率高于聚体,可以采用其单体己内酰胺毒理数据。
通过结构类似物推测。如甲基磷酸二正丁酯[29],未发现有效毒理学试验方面的数据报道,其结构类似物甲基磷酸二异丙酯毒理数据可作为参考。此方法没有明确的法规规定,需要有化学和毒理背景的专家评判。
通过生理条件下的降解产物毒理确定安全阈值。如二甲基二乙酰氧基硅烷,尚未发现相关毒性试验报道。在生理条件下,二甲基二乙酰氧基硅烷会分解成二甲基硅烷二醇(DMSD)和醋酸。可以通过DMSD和醋酸的毒理学数据进行二甲基二乙酰氧基硅烷的毒理评估。
对于结构已知的化学物质,可以通过QSAR软件预测该物质是否具有突变性。如具有突变性,按照ICH M7设定阈值进行计算;如不具有突变性,采用Cramer规则进行阈值判定。对于结构未知的化学物质,参考毒理学关注阈值,如果杂质是基因突变性,按照ICH M7设定阈值进行计算[30]。
4 结语
一次性使用组件或容器密闭系统的评估包括功能性和E&L安全性评估;E&L研究及其安全性评估和患者的健康密切相关。毒理学评价是E&L安全性评估的重要环节,需要结合化学、药学和毒理学相关专业知识,制定合理的评估策略;安全性阈值的确定也决定了相关分析方法开发的目标。E&L实验研究国内外有比较完备的法规,如《化学药品与弹性体密封件相容性研究技术指导原则(征求意见稿)》,USP<665>、<1663>、<1664>和<1665> 等指导性文件,但E&L的毒理数据评价却一直没有明确的法规。
E&L毒理学评估的常见问题有4个:
(1)安全阈值的计算不合理,如PDE的生物利用率安全系数选用,NOAEL评估的合理性(生殖毒性数据不等同于系统毒性数据);
(2)特殊关注化合物(cohort of concern,COC),如亚硝胺类、多环芳烃类和2-巯基苯并噻唑类等,需要根据特定的毒理学研究数据(敏感种属敏感部位的LD50)来设定相应的可接受限度;
(3)关于Cramer规则的利用,前提是该化合物基因突变结果为阴性(通过Ames细菌回复突变结果判断,或者基于QSAR判断);
(4)关于类似物替代评估运用,结构类似物选择的合理性,需考虑其在ADME或者相关毒理学终点是否一致等。为了解决以上问题,本文详细介绍了毒理试验的选择,以及毒理试验中关键毒性效应的考察要点,为安全阈值的计算提供依据。
在E&L研究过程中,合理和科学的毒理数据评价可以避免一些不必要或冗余的毒理学试验要求,也使风险评估更合理,这是日趋严格的E&L研究方向。
利益冲突 所有作者均声明不存在利益冲突
参考文献(略)
来 源:谢阳国,程盈,侯伟,张仲理,张磊.可提取物与浸出物的毒理学风险评价策略 [J]. 药物评价研究, 2022, 45(7): 1446-1452 .
版权声明:CosMeDna所有作品(图文、音视频)均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系删除!
本文链接://www.cosmedna.com/article/426982513.html